Рада 1: Що таке хімічну будову
Рада 1: Що таке хімічну будову
Теорія хімічної будови - це теорія, якаописує, в якому порядку розташовуються атоми в молекулах органічних речовин, яке взаємний вплив атоми надають один на одного, а також які хімічні і фізичні властивості речовини випливають з цього порядку і взаємовпливу.

Рада 2: Що таке взаємно прості числа
Взаємно прості числа - математичне поняття, яке не слід плутати з числами простими. Спільне між двома поняттями полягає лише в тому, що обидва вони мають пряме відношення до поділу.

Простим в математиці називається таке число,яке можна розділити тільки на одиницю і на саме себе. 3, 7, 11, 143 і навіть 1 111 111 - все це прості числа, причому кожне з них має даними властивістю в отдельності.Чтоби говорити про взаємно простих числах, їх повинно бути не менше двох. Дане поняття характеризує загальний ознака кількох чисел.
Визначення взаємно простих чисел
Взаємно простими називаються такі числа, якіне мають спільного дільника, не рахуючи одиниці - наприклад, 3 і 5. При цьому кожне число в окремо може і не бути простим само по себе.Напрімер, число 8 до таких не належить, адже його можна розділити на 2 і на 4, але 8 і 11 - взаємно прості числа. Визначальною ознакою тут є саме відсутність загального дільника, а не характеристики окремих чісел.Впрочем, два і більше простих числа завжди будуть взаємно простими. Якщо кожне з них ділиться лише на одиницю і на саме себе, то загального дільника у них бути не может.Для взаємно простих чисел існує особливе позначення у вигляді горизонтального відрізка і опущеного на нього перпендикуляра. Це співвідноситься з властивістю перпендикулярних прямих, у яких немає загального напрямку, як і у цих числі немає спільного дільника.Попарно взаємно прості числа
Можливо і таке поєднання взаємно простих чисел,з якого можна взяти навмання будь-які два числа, і вони обов'язково виявляться взаємно простими. Наприклад, 2, 3 і 5: загального дільника не мають ні 2 і 3, ні 2 і 5, ні 5 і 3. Такі числа називають попарно взаємно простие.Не завжди взаємно прості числа бувають попарно взаємно простими. Наприклад, числа 15, 20 і 21 - це взаємно прості числа, але назвати їх попарно взаємно простими не можна, адже 15 і 20 діляться на 5, а 15 і 21 - на 3.Застосування взаємно простих чисел
У ланцюгової передачі, як правило, кількістьланок ланцюга і зубів зірочки виражаються взаємно простими числами. Завдяки цьому кожен з зубів стикається з кожною ланкою ланцюга по черзі, механізм менше ізнашівается.Существует і ще більш цікава властивість взаємно простих чисел. Необхідно накреслити прямокутник, довжина і ширина якого виражаються взаємно простими числами, і провести з кута всередину прямокутника промінь під кутом 45 градусів. У точці дотику променя зі стороною прямокутника потрібно накреслити інший промінь, розташований під кутом 90 градусів до першого - відображення. Роблячи такі промені-відображення раз по раз, можна отримати геометричний візерунок, в якому будь-яка частина за структурою подібна до цілого. З точки зору математики такий узор є фрактальним.Рада 3: Що таке травна система людини
Людині для життєдіяльності необхідніпоживні речовини: білки, амінокислоти, моносахара і т.п. Все це є в продуктах харчування, але в складному, малоусвояемом вигляді. Щоб клітини отримали необхідні їм речовини, їжа повинна бути піддана розщепленню. Це завдання виконує травна система.
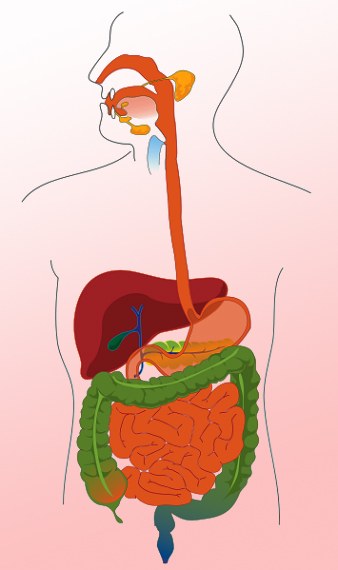
Рада 4: Що таке інертний газ
Інертні гази в таблиці Менделєєва - це елементиголовної підгрупи VIII групи: гелій, неон, аргон, криптон, ксенон і радон, причому останній є радіоактивним елементом. Вони називаються також благородними газами.

Електронна будова інертних газів
Все інертні гази мають завершену, стійкуконфігурацію зовнішнього електронного рівня: у гелію це дублет, у інших газів - октет. Кожен з них завершує відповідний період в таблиці Менделєєва.Інертні гази в природі
Все інертні гази, крім радіоактивного радону,можна знайти в складі атмосферного повітря. Гелій - найпоширеніший елемент у космосі після водню. Сонце на 10% складається з цього благородного газу, утвореного з водню по реакції ядерного синтезу з виділенням позитронів і антинейтрино.Фізичні властивості інертних газів
Інертні гази представлені одноатомнимимолекулами. При звичайних умовах гелій, неон, аргон, криптон і ксенон - гази без кольору і запаху, погано розчинні у воді. Чим більше їх атомний номер, тим вище температури кипіння і плавленія.Гелій володіє унікальними властивостями: він залишається рідким навіть при найнижчих температурах, аж до абсолютного нуля, не наражаючись кристалізації. Кристалізувати гелій можливо лише під тиском 25 атмосфер. Крім того, у цього газу найнижча температура кипіння з усіх речовин.Хімічні властивості інертних газів
Довгий час вважалося, що інертні гази взагаліне утворюють сполук. Однак експериментально при особливих умовах були отримані фториди і оксиди ксенону, існування яких було передбачене теоретиком Лайнусом Полингом.Як застосовують інертні гази
Завдяки своїм видатним фізико-хімічнимивластивостями інертні гази широко використовуються в науці і техніці. Так, за допомогою рідкого гелію отримують наднизькі температури, а суміш гелію і кисню в співвідношенні 4: 1 використовується як штучна атмосфера для дихання водолазов.Поскольку гелій - найлегший газ після водню, їм часто наповнюють дирижаблі, зонди і аеростати. Його підйомна сила дорівнює 93% від підйомної сили водорода.Неон, аргон, криптон і ксенон застосовуються в світлотехніці - виробництві газорозрядних трубок. При пропущенні електричного струму через трубки, наповнені неоном або аргоном, газ починає світитися, а колір цього випромінювання залежить від тиску газа.Аргон як найдешевший з благородних газів використовується для створення інертної атмосфери при проведенні хімічних реакцій, продукти яких взаємодіють з киснем.Рада 5: Що таке атомна орбіталь
Будь-яка речовина в природі складається з найдрібнішихчастинок, званих атомами. Їх розміри настільки малі, що по суті ці частинки ще ніхто не бачив, а дані про їх структуру та властивості засновані на численних експериментах з використанням різноманітних складних приладів.
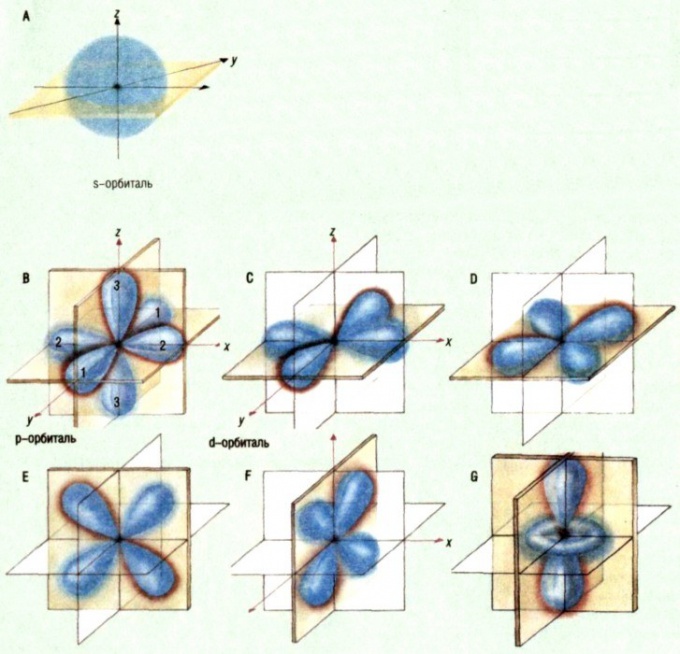
будова атома
Атом складається з двох основних частин: ядра і електронної оболонки. У свою чергу ядро являє собою комбінацію протонів і нейтронів, які разом звуться нуклони; електронна оболонка ядра складається тільки з електронів. Ядро має позитивний заряд, оболонка - негативний, а разом вони утворюють електронейтральний атом.Історія
Як було сказано раніше, атом складається з ядра ірухаються навколо нього електронів. Нерідко, щоб спростити схематичні малюнки атомів, вважають, що електрони обертаються по кругових орбітах, як планети Сонячної системи навколо Сонця. Цю наочну модель запропонував в 1911 році видатний англійський фізик Ернест Резерфорд. Однак експериментально довести її не вдавалося, і від терміна «орбіта» почали поступово відмовлятися. Вже на початку 30-х років ХХ століття було остаточно встановлено, що електрон в атомі взагалі не має певної траєкторії руху. Саме тоді в роботах американського фізика Роберта Маллікен і німецького фізика Макса Борна почав з'являтися новий термін - орбіталь - співзвучний і близький за змістом орбіті.електронне хмара
Електронне хмара - це вся сукупність точок,в яких побував електрон за певний проміжок часу. Та область електронної хмари, в яких електрон з'являвся частіше, і є орбиталь. Найчастіше, даючи визначення цьому терміну, говорять, що це те місце атома, де місце розташування електрона найбільш ймовірно. При цьому слово «ймовірно» грає тут ключову роль. В принципі, електрон може перебувати в будь-якій частині атома, але ймовірність виявити його де-небудь поза орбіталі вкрай мала, тому прийнято вважати, що орбиталь становить приблизно 90% електронного хмари. Графічно орбиталь зображують у вигляді поверхні, яка окреслює область, де поява електрона найбільш ймовірно. Наприклад, у атома водню орбиталь має сферичну форму.типи орбіталей
В даний час вчені визначають п'ять типіворбіталей: s, p, d, f і g. Їх форми були обчислені методами квантової хімії. Орбіталі існують незалежно від того, знаходиться на них електрон чи ні, при цьому атом кожного елемента, відомого в даний час, має повний набір всіх орбіталей.В сучасної хімії орбиталь є одним з визначальних понять, яке дозволяє досліджувати процеси утворення хімічних зв'язків.Рада 6: Що таке валентність
валентність - один з основних термінів, що вживаються втеорії хімічної будови. Це поняття визначає здатність атома утворювати хімічні зв'язки і кількісно представляє собою число зв'язків, в яких він бере участь.

Інструкція
1
валентність (Від лат. valentia - «сила») - показник здатності атома приєднувати до себе інші атоми, утворюючи з ними хімічні зв'язки всередині молекули. Загальна кількість зв'язків, в яких може брати участь атом, дорівнює числу його неспарених електронів. Такі зв'язки називаються ковалентними.
2
Неспарені електрони - це вільні електронизовнішньої оболонки атома, які з'єднуються в пари із зовнішніми електронами іншого атома. При цьому кожна така пара називається електронної, а такі електрони - валентними. Виходячи з цього, визначення валентності може звучати так: це число електронних пар, за якими даний атом пов'язаний з іншими атомами.
3
валентність атома схематично зображується в структурних хімічних формулах. Якщо ж така інформація не потрібна, то використовують найпростіші формули, в яких валентність не вказується.
4
Максимальний показник валентності хімічнихелементів однієї групи періодичної системи, як правило, дорівнює порядковому номеру групи. У різних хімічних сполуках атоми одного елемента можуть мати різну валентність. Полярність утворюються ковалентних зв'язків не враховується, тому валентність не має знака. Вона не може бути ні нульовий, ні негативною величиною.
5
Кількісною мірою будь-якого хімічного елементаприйнято вважати число одновалентних атомів водню або двовалентних атомів кисню. Однак при визначенні валентності можна використовувати і інші елементи, валентність яких точно відома.
6
Іноді поняття валентності ототожнюють зпоняттям «ступінь окислення», однак це невірно, хоча в деяких випадках ці показники збігаються. Ступінь окислення - формальний термін, що означає можливий заряд, який отримав би атом, якби його електрони в електронних парах перейшли до більш електронегативний атомів. При цьому ступінь окислення виражається в одиницях заряду і може мати знак, на відміну від валентності. Цей термін набув поширення в неорганічної хімії, оскільки в неорганічних сполуках важко судити про валентності. валентність ж використовується в органічній хімії, оскільки більшість органічних сполук має молекулярну будову.
Рада 7: Що таке іонна зв'язок
Іонна зв'язок - це одна з різновидівхімічного зв'язку, що виникає між різнойменно зарядженими іонами електропозитивних і електронегативний елементів. Іони ж, як відомо, - це частинки, що несуть позитивний або негативний заряд, які утворюються з атомів при віддачі або приєднання електронів.
Рада 8: Що таке цитоплазма
цитоплазма - дуже важлива клітинна складова. В її напіврідкої внутрішньому середовищі розташовані органели, що відповідають за життєво важливі функції клітини. Рухливість цитоплазми сприяє взаємодії органел між собою. Це дає можливість виникнення процесів внутрішньоклітинного метаболізму.






